
14648I. Reglamentos y leyes
14649De acuerdo con la Ley sobre la Garantía de la Calidad, la Eficacia y la Seguridad de los Productos, incluidos los Productos Farmacéuticos y los Dispositivos Médicos (en adelante, Ley de Medicamentos y Dispositivos Médicos), los medicamentos ydispositivo medico14650la gestión se rige por este reglamento. La Ley de Medicamentos y Dispositivos Médicos proviene de la Ley Farmacéutica original, y sus disposiciones de implementación específicas incluyen el Decreto de Implementación de la Ley de Medicamentos y Dispositivos Médicos, el Decreto de QMS y otros anuncios y notificaciones relacionados.
14651II. órganos de gestión
14652La gestión de medicamentos y dispositivos médicos en Japón está a cargo principalmente de dos órganos de gestión, a saber, el Ministerio de Salud, Trabajo y Bienestar de Japón (MHLW) y la Agencia de Medicamentos y Dispositivos Médicos (PMDA).
14653III. Clasificación de dispositivos médicos
14654(1)Dispositivos médicos generales (Clase Ⅰ):14655Designado por el Ministro del Ministerio de Salud, Trabajo y Bienestar de Japón después de escuchar la opinión del Consejo Consultivo de Asuntos Farmacéuticos e Higiene Alimentaria, este tipo de dispositivos médicos tiene un riesgo menor de afectar la vida y la salud de las personas en caso de efectos secundarios o da?os funcionales.
14656(2)Dispositivos médicos gestionados (Clase Ⅱ):14657También designado por el Ministro del Ministerio de Salud, Trabajo y Bienestar de Japón después de escuchar la opinión del Consejo Consultivo de Asuntos Farmacéuticos e Higiene Alimentaria, este tipo de dispositivos médicos puede afectar la vida y la salud de las personas en caso de efectos secundarios o da?os funcionales, por lo que es necesario realizar una gestión adecuada.
14658(3)Dispositivos médicos altamente gestionados (Clase Ⅲ, Clase Ⅳ):14659Este tipo de dispositivos médicos tendrá un grave impacto en la vida y la salud de las personas en caso de efectos secundarios o da?os funcionales, por lo que debe gestionarse estrictamente.

14660IV. Modelo de certificación de dispositivos médicos y proceso de revisión de registro
14661Los fabricantes extranjeros que deseen exportar sus equipos a Japón deben registrarse en el Ministerio de Salud, Trabajo y Bienestar, este procedimiento se conoce como registro de fabricantes extranjeros (FMR). Este proceso seguirá el procedimiento de revisión de registro de dispositivos médicos de Japón PMD Act & Decreto no 169 IS0 13485.
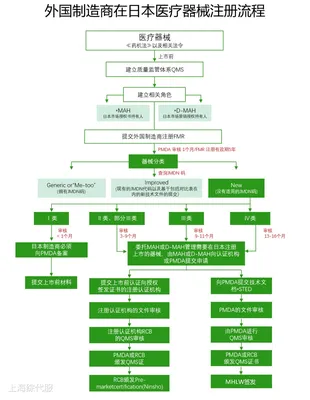
14662V. Aspectos clave a tener en cuenta
14663(1)Titular de la autorización de comercialización (MAH)/Titular de la autorización de comercialización (D-MAH):14664Los fabricantes extranjeros deben designar un titular de la autorización de comercialización en Japón, esta es una condición previa para la venta de dispositivos médicos en Japón.
14665(2)Resumen STED (datos de registro):14666Debe incluir especificaciones del producto, datos de estabilidad y vida útil, datos de pruebas de rendimiento, análisis de riesgos, datos clínicos, etc.
14667(3)Auditoría del sistema de gestión de la calidad (QMS):14668Realizada por la Agencia de Medicamentos y Dispositivos Médicos (PMDA) o un organismo de certificación registrado (RCB), el alcance de la auditoría incluye todos los lugares relacionados con el fabricante y el vendedor, el dise?o y la fabricación de dispositivos médicos.
14669(4)Requisitos de múltiples regulaciones:14670Los productos de dispositivos médicos importados al mercado japonés también deben cumplir con los requisitos de otras regulaciones, como la Ley de Seguridad Eléctrica y la Ley de Radiocomunicaciones.


 Siga el servicio al cliente WeChat
Siga el servicio al cliente WeChat